2020年4月6日,中国科学院分子细胞科学卓越创新中心陈玲玲团队在 Cell 杂志发表题为:Distinct processing of lncRNAs contributes to non-conserved functions in stem cells的研究论文。该研究首次发现长非编码RNA在不同物种来源干细胞中的特异性加工是其发生适应性功能变化的重要机制,为深入理解长非编码RNA的功能及进化提供了新思路。
这项最新研究通过分离人、鼠胚胎干细胞细胞核和细胞质来源的RNA结合高通量测序分析, 首次发现人、鼠胚胎干细胞中长非编码RNA的加工及亚细胞定位存在显著差异。序列及基因组位置保守的长非编码RNA在人胚胎干细胞中更多的定位在细胞质内,而在鼠胚胎干细胞中则更多的滞留在细胞核内。值得一提的是,多个定位在人胚胎干细胞细胞质中的长非编码RNA参与维持人干细胞自我更新,而相应的基因组位置保守的长非编码RNA则更趋向于定位在鼠胚胎干细胞核内,对干细胞维持没有明显作用。这些 长非编码RNA在不同物种来源的干细胞内的亚细胞定位的不同,提示它们在人、鼠的胚胎干细胞中可能具有不同的加工方式和生物学功能。
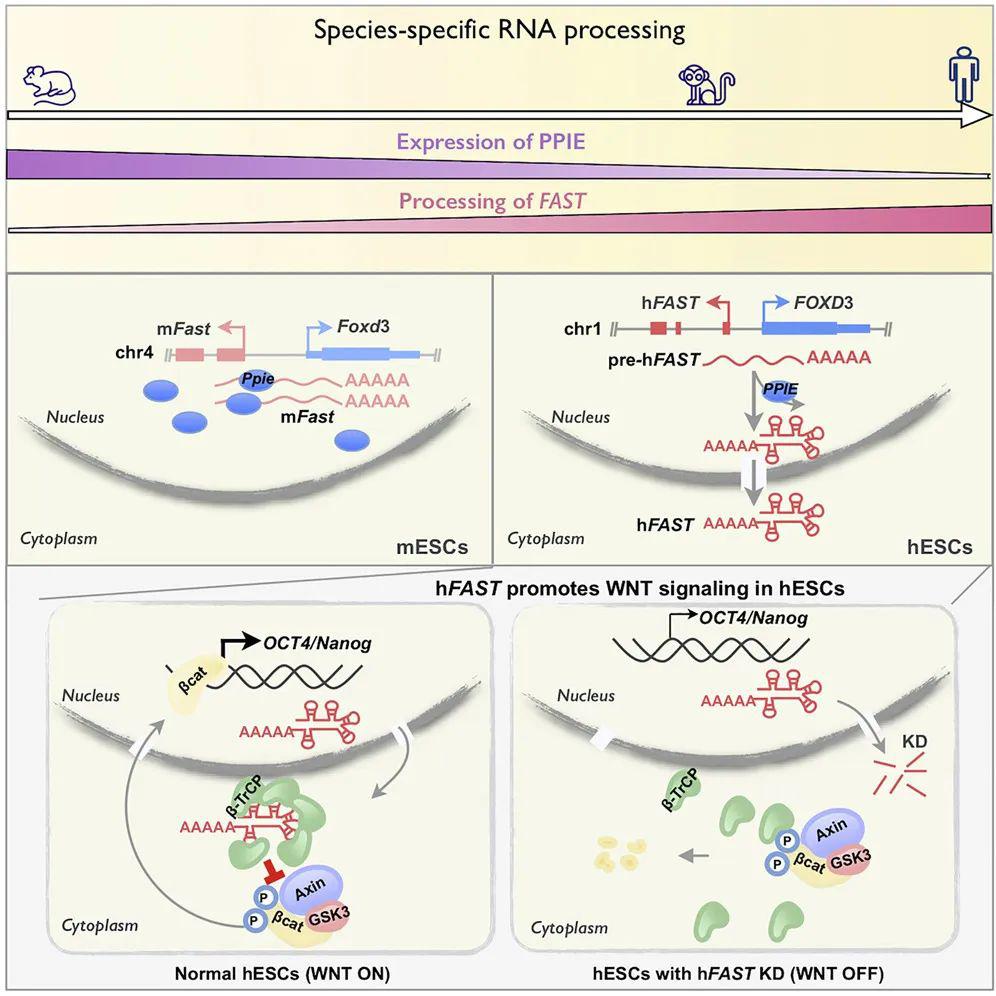
研究详细解析了其中一个新型的长非编码RNA —— FAST 在维持人胚胎干细胞自我更新的分子机制。 FAST 是基因组位置保守的长非编码RNA,在胚胎干细胞中特异高表达。在人、猴来源的胚胎干细胞h FAST 定位在细胞质内,维持胚胎干细胞的自我更新。机制研究表明,在人胚胎干细胞中,细胞质定位的h FAST 结合β-TrCP蛋白,使β-TrCP不能降解重要信号通路WNT中关键蛋白β-catenin,从而维持WNT信号通路持续激活和干细胞的自我更新。在鼠源胚胎干细胞中,m Fast 定位在细胞核内,不能结合β-TrCP,也不影响WNT信号通路和干细胞多能性。
为了进一步探究长非编码RNA在不同物种间加工定位差异的分子机制,研究人员结合生物信息学分析预测和实验验证 筛选到了调控它们不同定位的关键因子PPIE。在鼠胚胎干细胞中,PPIE蛋白高表达并抑制长非编码RNA (包括m Fast ) 的剪接加工而使其滞留在细胞核内;在人胚胎干细胞中,PPIE蛋白低表达,使得更多的长非编码RNA被剪接加工并得以运输到细胞质内发挥功能;而在猴胚胎干细胞中PPIE蛋白的表达、 FAST 以及其它长非编码RNA在细胞内的定位和功能则更趋向于人胚胎干细胞。
该工作首次发现非保守的RNA加工和定位在长非编码RNA发挥功能过程中具有重要作用,从而提示长非编码RNA的姿态万千可能是物种特异性的调控和适应的一个重要机理。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(20)30268-3