生物医疗智能计算团队的扈国栋教授和美国伊利诺伊大学芝加哥校区的Huan-Xiang Zhou教授合作了近四年。近期的又一合作成果《Magnesium ions mediate ligand binding and conformational transition of the SAM/SAH riboswitch》在Nature旗下子刊Communications Biology发表。
细菌内有一类特有的非编码RNA分子——核糖开关,它能够结合代谢小分子并发生构象变化,不仅可以进行转录调控而且还可以在翻译过程进行基因表达调控。研究核糖开关的结构功能关系,对抗菌类药物设计和代谢类生物传感器等的设计具有重要的意义。核糖开关结合小分子具有特异性,然而,SAH/SAM核糖开关能够结合SAH和SAM两种小分子,没有体现出选择性。镁离子具有两个电荷,能够中和RNA自身的电荷,起到稳定结构发挥功能的作用。然而,镁离子、钠离子和水分子具有相同的电子数,实验上测得镁离子的位置是很困难的。为此,本研究采用计算的方法探索镁离子在SAH/SAM核糖开关中发挥功能的方式。
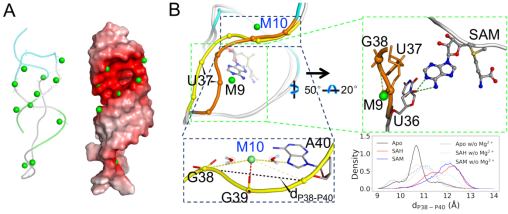
研究采用了大规模计算机模拟对模拟系统进行了总计120微秒的分子动力学模拟,预测了SAM/SAH核糖体开关中超过10个镁离子和RNA分子直接结合,其中的六个镁离子排列在小分子结合凹槽的两侧。我们的模拟给出了独特机制,特别是,小分子SAM的甲基暴露在溶剂中,导致SAM和SAH与核糖开关核苷酸的相互作用能相似,但以硫为中心的正电荷仍然有利于SAM而不是SAH。镁离子为SAH提供了补偿作用,并减弱了两种配体之间的选择性。没有甲基,一个镁离子能更好地与SAH羧基形成外壳配位,稳定U16-SAH氢键。镁离子通过静电相互作用,增加了凹槽的宽度,为小分子进入结合腔起到了预组织结合腔的作用,从而降低了进入配体结合腔的能垒。我们进一步推测,这些镁离子可能通过与配体的羧基部分的外壳配位,使配体有更多的机会进入配体结合腔。更重要的是,虽然镁离子通常被认为可以稳定包括螺旋元件在内的RNA结构,但我们对单体形式中镁离子(M10)的研究表明,它也可以特异性地与螺旋元件的一条链相互作用,并将其从互补链上剥离,从而导致SAM/SAH核糖开关最终释放SD序列。实验结果验证了我们计算结果的一些关键内容,如:MD模拟计算的RMSF曲线与实验对应的曲线数据吻合。总之,镁离子在SAM/SAH核糖开关发挥功能的过程中起着至关重要的作用,本研究将有利于相关核酸类抗菌药物的设计。
本研究得到了山东省自然科学基金,国家自然科学基金和美国NIH基金的支持。
在线文章、同行评议、电子材料、影像资料获取网址:https://www.nature.com/articles/s42003-023-05175-5
(作者:扈国栋 供稿审核人:许士才)